撰稿 / 朱舢樺 (科學推展中心特約編輯)
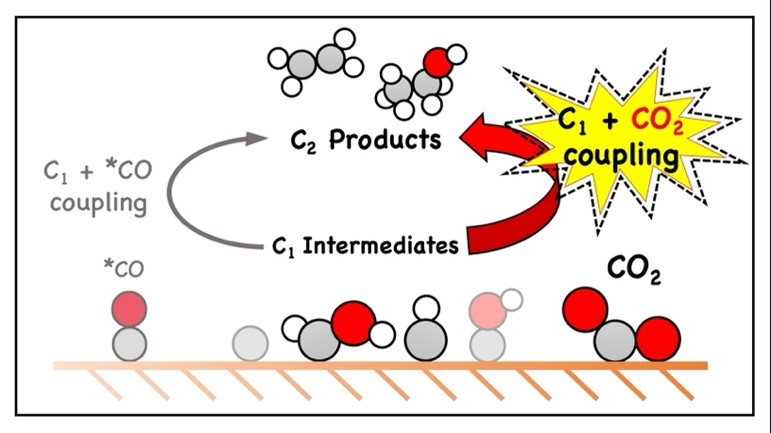
圖1. 二氧化碳還原反應機制示意圖
在全球暖化危機下,如何運用碳中和以達成二氧化碳減量,是一個重要的目標。而電催化二氧化碳還原對於實現碳中和有極大潛力。藉由催化劑的幫助,二氧化碳能夠還原成具工業價值的多碳化合物。國立成功大學化學系鄭沐政教授所帶領的研究團隊,以量子化學計算搭配定電極電位模型,發現銅催化之二氧化碳在鹼性環境下可作為極佳的碳–碳鍵形成試劑,此研究於2023年8月發表於國際期刊ACS Catalysis。
在電催化二氧化碳還原反應領域中,過往探討碳–碳鍵的生成的研究,均著重在兩個吸附在表面的一氧化碳(*CO,*表示吸附在表面上)進行二聚化,或是*CO與其他*C1中間體耦合(如圖1. 灰色箭頭路徑)。但研究團隊提出了一個迄今尚未在實驗或理論上探討的假設:既然二氧化碳是此還原反應的反應物且濃度遠高於其他*C1中間體,那有沒有可能碳–碳鍵的生成是來自*C1中間體與二氧化碳的耦合(如圖1. 紅色箭頭路徑)?
研究團隊先從動力學來探討,探討了在二氧化碳還原成甲烷的過程中,九個*C1中間體與二氧化碳反應之活化能,如圖2. 所示。由左至右表示施加電壓愈來愈負,縱軸高度是活化能。在更負的電壓下,所有反應的活化能皆下降。這是因為負電壓使表面帶更多負電,讓*C1中間體更容易用電子去攻擊二氧化碳。從圖2. 中也可以看到,有七個CO2 + *C1耦合反應的活化能小於快速電化學反應之活化能臨界值(如圖2. 中的黑線所示),代表反應有機會進行。這七個容易進行CO2+*C1反應在動力學上也比*CO + *C1有利(如圖3. 所示),打破了以往C–C 鍵的生成至少涉及一個*CO的觀點。
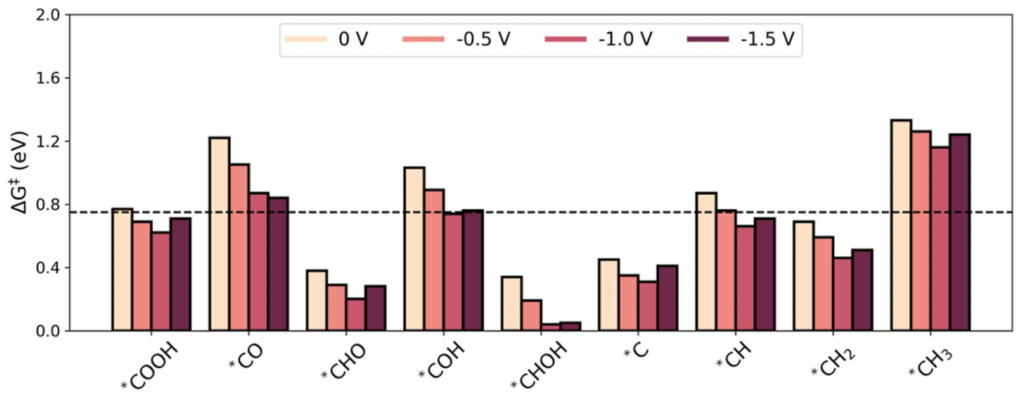
圖2. 不同電壓下,九個CO2+*C1耦合反應之活化能柱狀圖。黑色虛線代表∆G‡= 0.75 eV(快速電化學反應所需的標準)。
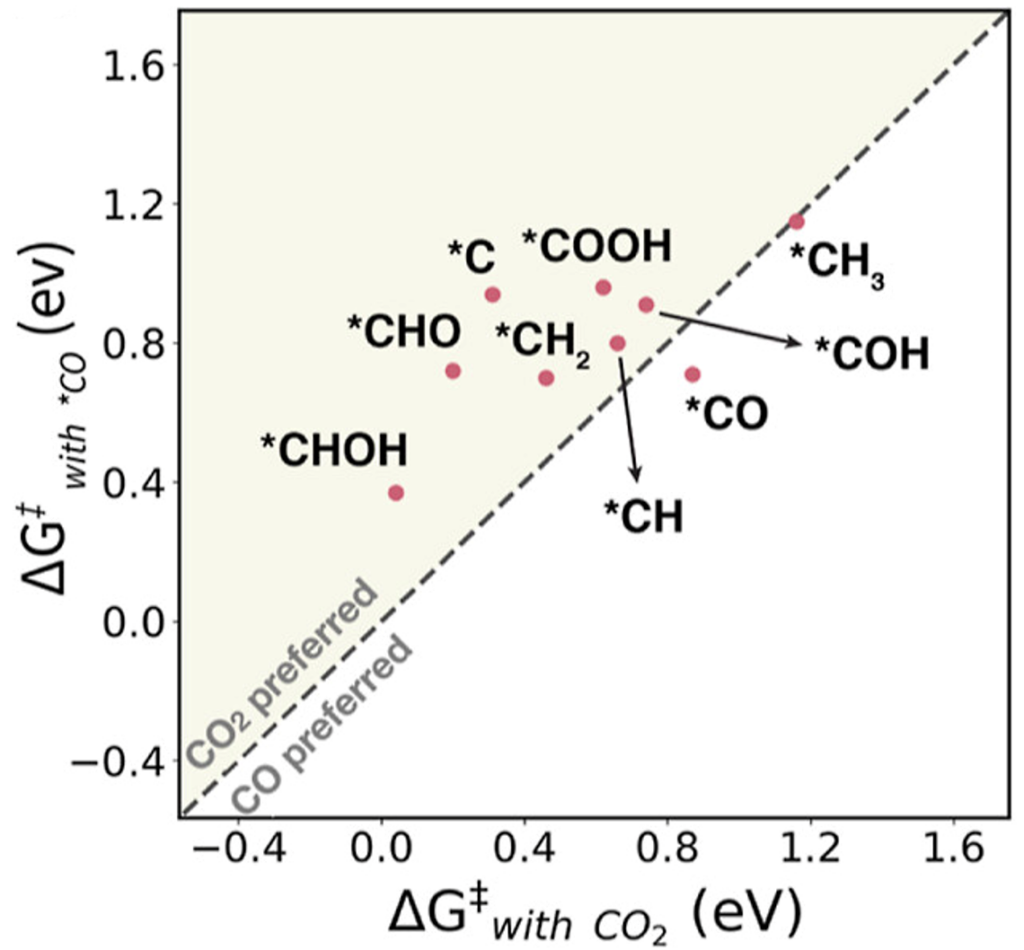
圖3. 在電壓為-1.00 VSHE下,比較CO2 + *C1和*CO + *C1之活化能對角線圖。
研究團隊為探討CO2 + *C1反應較*CO + *C1反應更容易發生的原因,藉由團簇模型(cluster model)分析後,發現上述兩個反應中,形成C–C鍵的兩個電子皆主要來自*C1,如圖4. (以*COOH為例)。利用Bader 電荷分析得知,因為CO2有兩個羰基,不論是吸附的CO2或氣態的CO2,碳原子正電性都比CO的高,使CO2較CO更容易被*C1的電子攻擊,讓C–C鍵更容易生成。
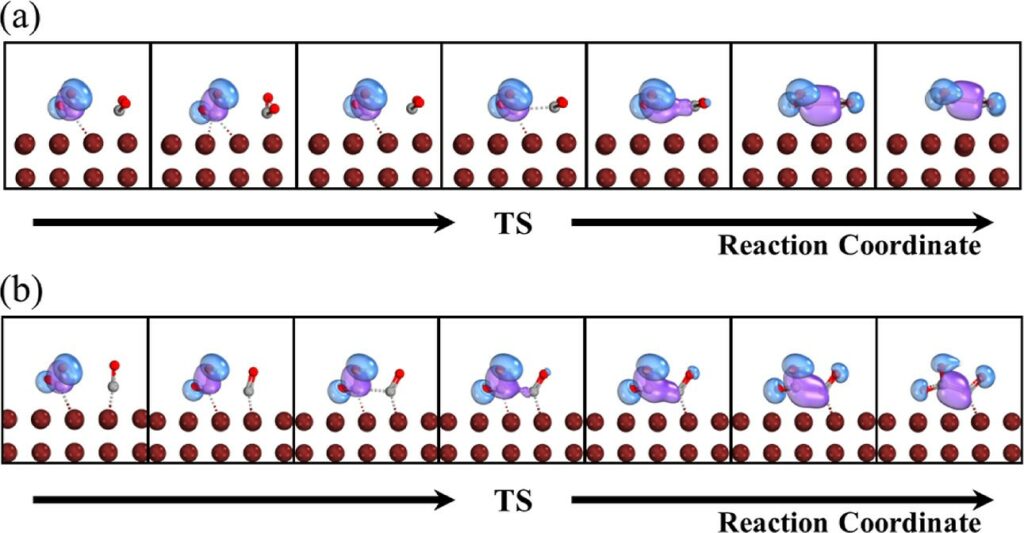
圖4. C−C σ-鍵之分子軌域的演變於 (a) CO2 + *COOH和 (b) *CO + *COOH沿著C−C生成途徑的過程。
研究團隊也與北京清華大學的陸奇教授合作,驗證此機制是否真的存在。團隊利用銅奈米粒子在鹼性環境下進行一氧化碳還原反應(COER)與二氧化碳還原反應(CO2ER),並且檢視兩反應的產物。若上述計算結果為真,CO2ER和COER的產物分佈應該有所不同,因為前者傾向進行CO2 + *C1反應,後者進行CO + *C1反應。而研究發現在-1.40 VSHE的條件下,這兩個反應的C2+產物分佈確實有所不同(圖5. (b)),CO2ER產物以乙烯為主,而COER則是乙烯與乙酸為主要產物,甚至還有正丙醇的產生。特別的是,在此反應條件下,CO2ER的產物沒有甲烷(圖5. (a)),表示和氫化反應相比,*C1中間體更容易進行CO2 + *C1耦合產生C2+產物。此研究為二氧化碳在催化反應中的核心角色提供了深入且嶄新的見解,也為永續化學研究提供了有價值的洞察。
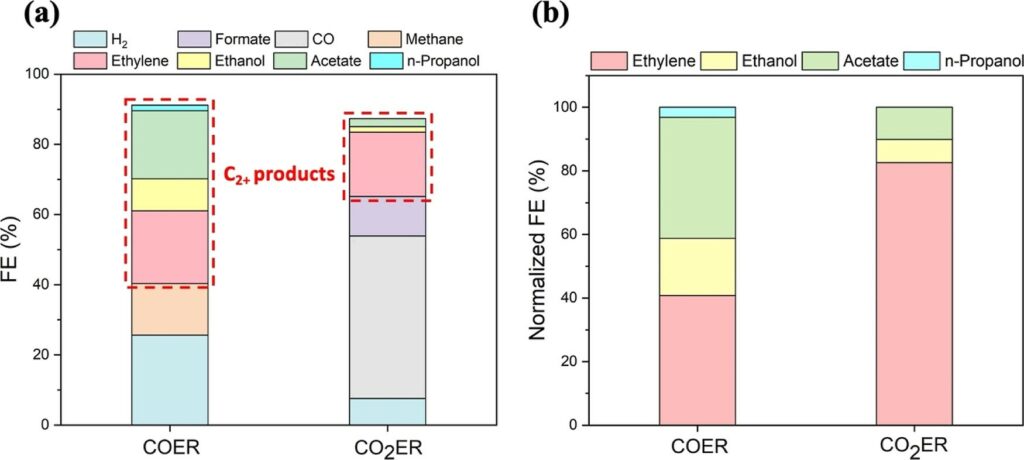
圖5. (a) 在-1.40 VSHE和pH = 14.0的條件下,CO2ER與COER之產物法拉第效率; (b) CO2ER與COER之歸一化碳二產物法拉第效率。