撰稿 / 張鳳吟 (科學推展中心特約編輯)
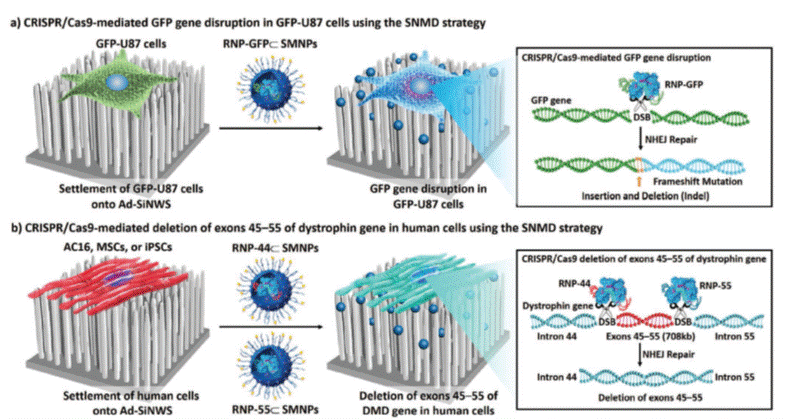
圖1. 超分子奈米基底遞送(supramolecular nanosubstrate-mediated delivery)策略應用於 (a)基因破壞(gene disruption) 與 (b) 基因刪除(gene deletion) 兩種基因編輯示意圖。
中興大學化學系李進發終身特聘教授兼系主任,與加州大學洛杉磯分校(UCLA)前奈米中心(CNSI)主任Paul S. Weiss教授、分子藥理所曾憲榮教授組成的前瞻研究團隊,利用奈米技術大幅改善CRISPR / Cas9基因編輯系統對於標靶細胞的遞送效率。該技術將提供遺傳疾病患者臨床治療的解決方案,成果於6月發表在國際權威期刊《Small》。
去年(2020年)諾貝爾化學獎頒給了法籍微生物學家、生化學家艾曼紐爾•夏本提爾(Emmanuella Charpentier)與美籍生化學家珍妮佛•道納(Jennifer Doudna),以表彰她們對CRISPR/Cas9基因編輯技術發展的貢獻。CRISPR全名為Clustered Regularly Interspaced Short Palindromic Repeats (常間回文重複序列叢集),是存於細菌的一種基因,在1987年由日本科學家從大腸桿菌的基因體中發現。這組基因有某一小段DNA會一直重複,重複片段間有一樣長的間隔(Spacer),儲存曾經攻擊該細菌的病毒DNA片段,當病毒再次入侵時,細菌可以依此辨識病毒給予反擊。
細菌的反擊工具為一種可以切割病毒DNA的Cas9內切酶,細菌以CRISPR的舊病毒DNA片段為模板,打造一個互補的引導RNA(guide RNA,gRNA),Cas9透過gRNA辨識出曾入侵的病毒,將其DNA切斷,因此它又稱為「基因剪刀」。CRISPR/Cas9基因編輯系統即是受細菌這種免疫機制所啟發:在實驗室打造特定gRNA,與Cas9結合成Cas9•gRNA複合體,送進細胞,Cas9依據gRNA便能在基因組對應的特定位置,將有問題的DNA去除,DNA隨即啟動修復機制完成基因編輯。
李進發教授表示,迅速有效的CRISPR / Cas9基因編輯技術已廣泛應用於基礎研究、生技產品開發及醫學研究,然而脱靶(off target)效應及遞送工具的選擇是此技術急需突破的主要關鍵。脫靶效應來自於基因剪刀未必在正確的標的位置上裁切,一旦切錯位置,將造成難以預測的副作用,影響CRISPR技術在基因疾病治療臨床應用的發展。另外是遞送工具的選擇,目前CRISPR / Cas9系統主要仰賴病毒載體遞送至細胞,但病毒載體受限於包裝量能與安全考量,讓一些科學家開始致力於非病毒載體的開發(包含脂質、高分子與奈米粒子),由於運載的Cas9重量為160 kDa,因此發展高效遞送策略的載體是該領域的重要前沿研究。
李進發教授與跨國團隊,受到已有的基底媒介遞送(substrate-mediated delivery)方法的啟發,結合之前發展的超分子奈米粒子自組裝(self-assembled)技術,開發出一套超分子奈米基底媒介的遞送策略(supramolecular nanosubstrate-mediated delivery)來增進超分子奈米粒子載體的遞送效率。其中,Cas9•sgRNA(single-guide RNA)複合體以自組裝包入奈米超分子內,奈米基底是由與超分子具相同接枝(graft)材料的奈米線組成,透過分子辨識與自組裝效應,超分子奈米顆粒聚集在奈米線,細胞放在奈米基底上,細胞膜與奈米線接觸產生瞬間的缺陷, 增加了細胞內對超分子的攝取,達到提升遞送效率的成效。由於非病毒載體Cas9•sgRNA複合體的遞送跳過基因轉譯的過程,具有快速基因編輯的優勢,因此減少脫靶的行為。
研究團隊將這個策略成功應用在兩種基因編輯型式:基因破壞(gene disruption)與基因刪除(gene deletion)(圖1),其中後者利用遞送兩種sgRNA的超分子奈米粒子,高效率剪輯一大段肌肉萎縮蛋白(dystrophin)的基因,隨後DNA透過非同源性末端接合途徑(non-homologous end joining,NHEJ)修復,提供遺傳疾病裘馨式肌肉失養症(DMD)一個臨床解方,這也是文獻中使用非病毒載體最長的基因刪除紀錄。團隊未來的研究將專注在遞送包含DNA質體與mRNA的CRISPR/Cas9系統,以修正突變的基因,擴展能處理的疾病類型。團隊也計畫開發可移植進入標靶組織的奈米基底,開拓活生物體內應用的可能性。
此研究透過分子辨識技術,促進超分子奈米顆粒聚集於奈米線,確保CRISPR / Cas9系統進行基因編輯的效率,同時也降低脫靶效應。此一研究成果不僅在為治療基因遺傳疾病提供革命性的新思路及新希望外,由於在基礎醫學、藥理學、生物學、以及農業科技等相關領域上均能被廣泛應用的潛力,備受國際重視。