撰稿 / 陳宣豪 (科學推展中心特約編輯)
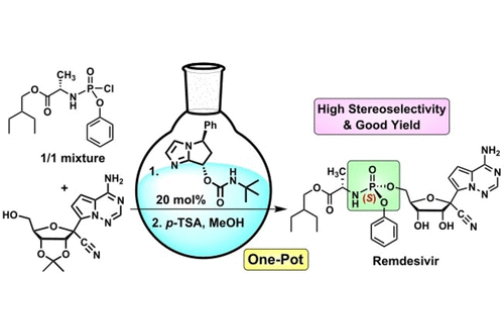
One-Pot Organocatalyzed Asymmetric (S)-P-Phosphoramidation
病毒感染宿主細胞,並依靠細胞內的基質,不斷複製產生大量的新病毒,再去感染其它更多的細胞。近期造成全球大流行的新冠肺炎,病毒容易發生突變,進而產生更易傳染或更高致病性的變異病毒,目前世界衛生組織(WHO)公布需注意的變異病毒株已包括α(英國)、β(南非)、γ(巴西)、δ(印度)、λ(祕魯)等等,意味著未來新冠肺炎可能會像流感一樣,需要定期更新預防用的疫苗和開發治療用的藥物,以供給全球近80億人使用。
全球第一個被認證抗新冠病毒藥物:瑞德西韋(Remdesivir)
美國吉利德科學公司 (Gilead Sciences, Inc.) 研發的抗病毒藥物「瑞德西韋」(Remdesivir),是全球第一個獲證用於治療「新冠肺炎」的藥物,台灣食藥署也批准有條件上市。瑞德西韋可以抑制新冠病毒的核糖核酸聚合酶,讓病毒無法在細胞內繼續複製,對於發病的患者有幫助。由於瑞德西韋的製造成本較昂貴,吉利德公司在2020年6月公布的訊息指出,每位病人五日的療程,所耗藥費約新台幣66,000元(註1),若能改良製程以降低生產成本,將讓更多需要的患者受惠。
高達50%材料耗損的原廠製程
中央研究院基因體研究中心洪上程特聘研究員的研究指出,吉利德公司合成瑞德西韋最後的二項步驟,包括先將核糖衍生的一級醇與丙胺酸衍生之不對稱磷中心光學活性化合物進行 SN2取代反應,接著在酸性水解條件下移除保護基,經純化後得到瑞德西韋。
導致製程成本疊高的關鍵步驟,就是丙胺酸衍生之不對稱磷中心光學活性化合物的製備,原廠製程中會產生1:1比例的立體異構物(S)及(R),多次結晶才能分離出下一步驟需要的高純度立體異構物(S),但產率僅有39%,且近半的立體異構物(R)完全無法使用,必須捨棄。
中研院「一鍋化」(One-Pot)不對稱催化反應
洪上程博士和翁啟惠院士領導的研究團隊共同合作,參考葡萄糖-6-磷酸根水解酶的作用機制,因其組胺酸(histidine) 側鏈上的咪唑 (imidazole),會加成到6-磷酸根,形成 [咪唑‒磷酸根] 中間體和葡萄糖,再讓水分子與 [咪唑‒磷酸根] 中間體進行水解反應,釋放出磷酸根。研究團隊構思若能設計出具光學活性的咪唑衍生物,利用三度空間障礙及反應平衡概念,能將原先會形成無法使用的的異構物中間體,平衡至期望的中間體來進行後續反應,達到降低耗損材料之目的。團隊使用咪唑和肉桂醛(Cinnamaldehyde)進行試驗,經分離純化後,取得能作為催化劑之具光學活性的雙環咪唑化合物,團隊首先嘗試各種不同催化條件,得到最佳不對稱磷中心異構物(S):(R) 的比例是96.1%:3.9%,接著進行「一鍋化」(One-Pot)反應探討,即在反應瓶裡直接加入酸性水解試劑,經終止反應及純化後,具光學活性的雙環咪唑催化劑可以被回收重複使用,接著利用再結晶方法得到高純度的瑞德西韋化合物。
中央研究院團隊所設計的「一鍋化」(One-Pot)不對稱催化反應,具有以下優點:(1)能將原廠瑞德西韋最後二項合成步驟的產率從48%提升至70%;(2)不浪費取代反應所需之丙胺酸衍生的磷中間體化合物;(3)省掉一步反應純化;(4)有機催化劑可以被回收重複使用;(5)只需一次再結晶,即可提升不對稱磷中心的異構物(S)的比例,得到99.3%高純度的瑞德西韋化合物。這項「一鍋化」改良製程,可以大幅降低耗損,且實驗量從100毫克、1克、放大到10克皆能達到同樣成效,該製程技術目前已申請專利,期許未來能技術移轉給製造原料藥(API)的公司進行產能提升開發,或超前部屬預防未來大規模疫情爆發之風險,確保自給自足能力,向原廠申請便能投入生產,更甚像口罩般供應國際各國、照拂需要的病友。
註1:美金匯率以28計算。
參考文獻
[1] Practical Remdesivir Synthesis through One-Pot Organocatalyzed Asymmetric (S)-P-Phosphoramidation(2021/02/26)
https://pubs.acs.org/doi/10.1021/acs.joc.0c02888
[2] 維基百科:世界人口
https://zh.wikipedia.org/wiki/%E4%B8%96%E7%95%8C%E4%BA%BA%E5%8F%A3#cite_note-1