撰稿 / 許芷辰 (科學推展中心特約編輯)
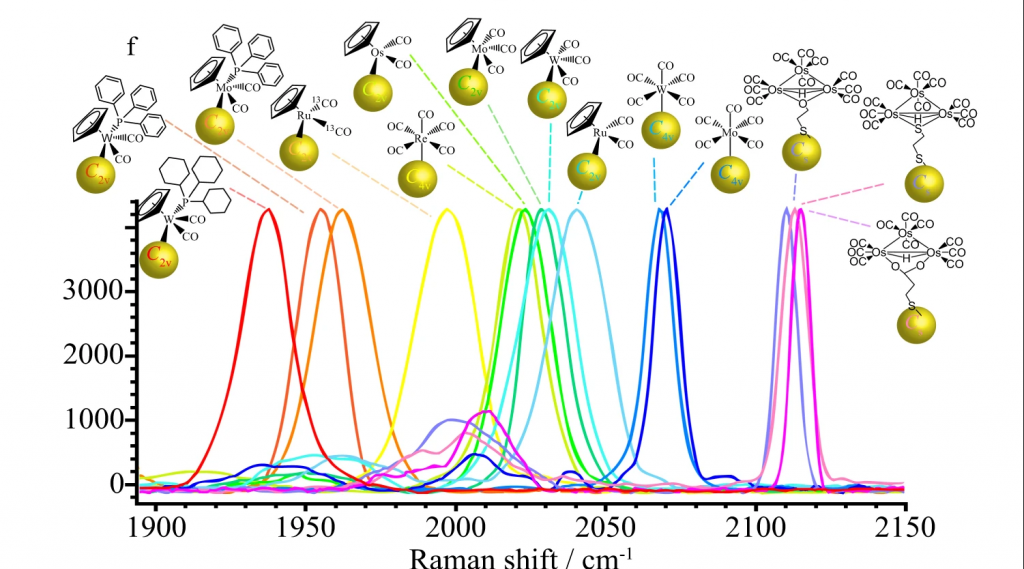
圖一、14種不同幾何構造的拉曼奈米探針與其對應的拉曼訊號。
為追求對抗疾病更好的途徑,除了醫療技術的突破,亦須倚賴醫療檢測器材的創新。自1928年發現拉曼光譜,歷經1974年Fleischmann等人發展出表面增強拉曼光譜,後人廣將其應用至優化各方生物感測器。最近研究團隊結合奈米材料,更加提升表面增強拉曼光譜生物感測器對疾病檢測精準度,獲刊登於國際頂尖期刊《Nature Communications》!
拉曼光譜與邏輯多重檢測的難題
拉曼光譜學(Raman spectroscopy)是研究當激發光打中待測物之後散射出波長不同於原本激發光的光譜,藉由偵測表面增強拉曼光譜(SERS)(因拉曼散射訊號微弱,故須透過表面增強放大),即可推出待測物的分子晶格特性與振動方式,非常適合運用在偵測小分子的生物感測器。其中重點是當偵測對象多於三個以上時,這樣的生物標記邏輯多重檢測是個難題,但臨床上疾病通常會有數個生物標記,要如何在放大拉曼訊號的同時,排除各式分子的互相干擾、增強其精準度依舊是多方學界努力的方向。
獨立SERS訊號的拉曼光學奈米探針
臺灣大學化學系江建文教授研究團隊與多方跨國團隊合作,設計一系列獨立SERS之拉曼光學奈米探針。成功設計出14個由不同幾何構造的金屬羰基化合物結合奈米金粒子,並以奈米凝膠為基底的奈米探針。而14個探針的訊號都落在拉曼光譜靜默區(1900-2100 cm-1),在靜默區中可排除掉其他來自非目標物所散射出的拉曼訊號(蛋白質或是DNA在此區域都沒有拉曼訊號)。
癌症與基質金屬蛋白酶(MMPs)蛋白水解活性
先前研究指出,癌細胞的轉移能力與其週遭基質金屬蛋白酶(matrix metalloproteinases, MMPs)降解細胞外基質有關,當MMPs濃度過高,分解細胞外基質,即可促進癌細胞在體內的轉移,故測量體內MMPs濃度可做為癌症分期的依據之一,其中又以MMP-2和MMP-9最為相關。研究團隊以鼻咽癌(NPC)作為初步研究對象,藉由改良版奈米拉曼探針,檢測微量濃度的MMPs,提供醫生後續治療指導分針。

圖二、同時對進行鼻咽癌患者的血液樣本進行拉曼光譜檢測與ELISA技術(傳統上在臨床檢測生物標記的方式),以檢測優化技術的精準度。
拉曼光譜生物感測器新突破,達臨床精準診斷需求
透過拉曼奈米探針可提供更快速簡便的方法檢驗疾病,其中研究團隊的改良也成功提出14種可行的幾何結構做微奈米金粒子上的結構,有效排出多因子的訊號干擾,同時也利用奈米凝膠基底穩定其訊號。在與傳統ELISA技術比較後,也可從圖三中看出幾乎無偏差,成功達到臨床上精準度的要求。
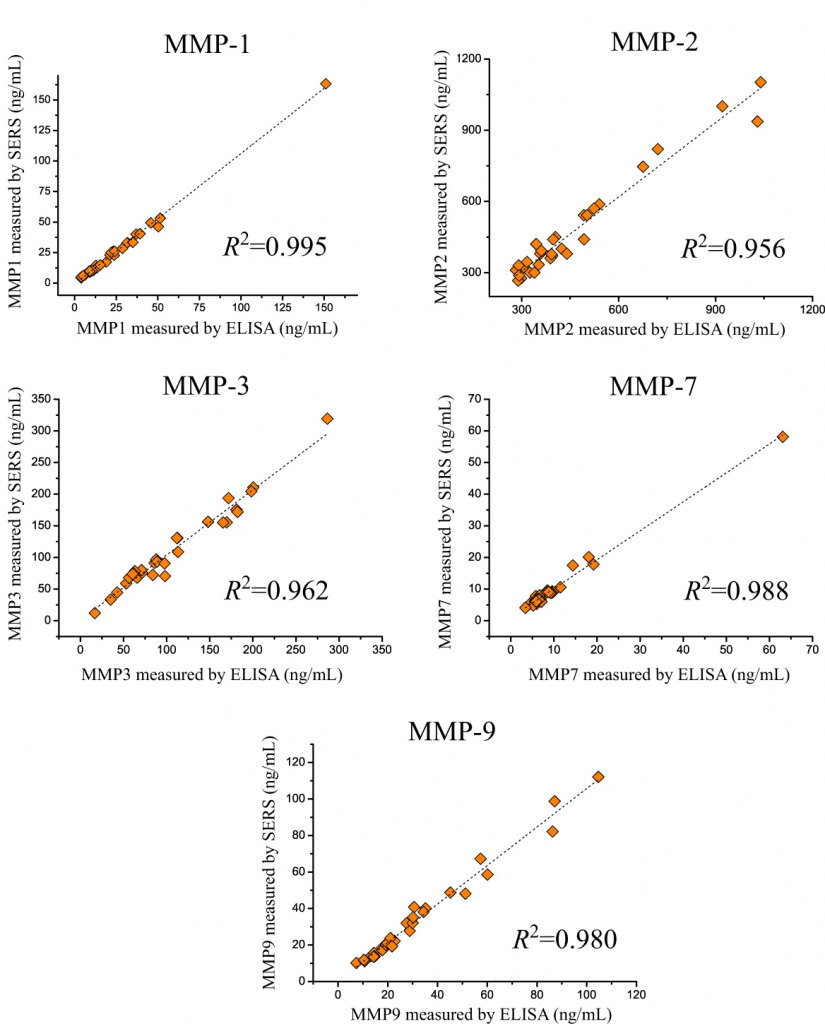
圖三、優化版拉曼檢測與傳統ELISA對於生物標記偵測之比較
參考文獻
[1] Duo Lin, Chang-Lin Hsieh, Keng-Chia Hsu, Pei-Hsuan Liao, Sufang Qiu, Tianxun Gong, Ken-Tye Yong, Shangyuan Feng & Kien Voon Kong (2021). Geometrically encoded SERS nanobarcodes for the logical detection of nasopharyngeal carcinoma-related progression biomarkers. Nature Communications volume 12, Article number: 3430 (2021). DOI:10.1038/s41467-021-23789-3.